O diretor geral do Instituto Butantan, Dimas Covas, afirmou nesta segunda-feira (9) que recebeu com estranheza a notícia de que a Agência Nacional de Vigilância Sanitária (Anvisa) suspendeu temporariamente os testes em humanos da vacina chinesa Coronavac no Brasil. A interrupção aconteceu, segundo a Anvisa, por causa de um "evento adverso grave", e foi anunciada também na noite desta segunda (9).
Segundo Dimas Covas, trata-se de "um óbito não relacionado à vacina" e, portanto, "não existe nenhum momento [ou motivo] para interrupção do estudo clínico" da vacina no Brasil."Ou seja, como são mais de 10 mil voluntários nesse momento, podem acontecer óbitos. Nesse momento, [o voluntário] pode ter um acidente de trânsito e morrer. Ou seja, é um óbito não relacionado à vacina. É o caso aqui. Ocorreu um óbito que não tem relação com a vacina. Portanto, não existe nenhum momento [ou motivo] para interrupção do estudo clínico", declarou Covas.
Segundo o jornalista José Roberto Burnier, da GloboNews, a morte do voluntário não foi causada por doença respiratória. O paciente, de 33 anos, também não tinha comorbidades.
Sem novas vacinações
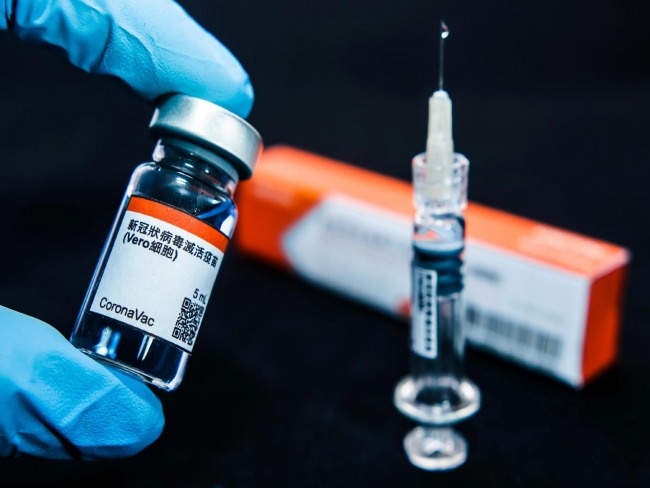
A Coronavac é uma das quatro candidatas a vacina contra o novo coronavírus (Sars-CoV-2) que estão sendo testadas no Brasil, em uma parceria da farmacêutica chinesa Sinovac com o Butantan. Com a interrupção do estudo, nenhum novo voluntário poderá ser vacinado.
A Anvisa disse, por meio de um comunicado, que foi notificada de um efeito adverso grave em 29 de outubro. A agência não informou, no entanto, a causa específica da suspensão.Dimas Covas afirmou que o Butantan já pediu esclarecimentos à Anvisa sobre a interrupção e que espera ter mais detalhes na manhã desta terça-feira (10).
"Essas questões foram colocadas agora à noite pela Anvisa, não foi ainda solicitado o esclarecimento. Nós já estamos solicitando e, de público, solicito aqui para que, amanhã [terça], na primeira hora, sejam fornecidos esses dados. Porque, na realidade, esse óbito não tem relação com a vacina", afirmou Dimas Covas.
Governo de São Paulo
Em nota, o Governo de São Paulo disse que "lamenta ter sido informado pela imprensa e não diretamente pela Anvisa" sobre a suspensão, "como normalmente ocorre em procedimentos clínicos desta natureza".
O Palácio dos Bandeirantes afirmou nesta segunda (9) que "aguarda informações mais detalhadas do corpo clínico da Agência Nacional de Vigilância Sanitária sobre os reais motivos que determinaram a paralisação".
"O Governo de São Paulo, através do Instituto Butantan, lamenta ter sido informado pela imprensa e não diretamente pela Anvisa, como normalmente ocorre em procedimentos clínicos desta natureza, sobre a interrupção dos testes da vacina Coronavac. O Butantan aguarda informações mais detalhadas do corpo clínico da Agência Nacional de Vigilância Sanitária sobre os reais motivos que determinaram a paralisação", disse a nota do Palácio dos Bandeirantes.O Butantan também se manifestou por meio de nota e afirmou que está "pedindo mais esclarecimentos à Anvisa". O instituto marcou uma coletiva de imprensa para às 11h desta terça (10) para esclarecer os motivos da interrupção dos estudos sobre a Coronavac no Brasil.
"O Instituto Butantan esclarece que foi surpreendido, na noite desta segunda-feira, com a decisão da Agência Nacional de Vigilância Sanitária (Anvisa) e que está apurando em detalhes o que houve com o andamento dos estudos clínicos da Coronavac. O Butantan informa ainda que está à disposição da agência reguladora brasileira para prestar todos os esclarecimentos necessários referentes a qualquer evento adverso que os estudos clínicos podem ter apresentado até momento", diz a nota.
Suspensão
A Agência Nacional de Vigilância Sanitária (Anvisa) suspendeu temporariamente os testes em humanos da vacina Coronavac. De acordo com a agência, a interrupção foi determinada nesta segunda-feira (9) por causa de um "evento adverso grave" em 29 de outubro.
A agência não informou, no entanto, a causa específica da suspensão.
Segundo uma lista divulgada pela agência federal, são considerados eventos adversos graves: "morte, evento adverso potencialmente fatal, incapacidade ou invalidez persistente, internação hospitalar do paciente, anomalia congênita ou defeito de nascimento, qualquer suspeita de transmissão de agente infeccioso por meio de um dispositivo médico e evento clinicamente significante".
A rádio CBN informou que a pausa nos ensaios clínicos foi dada depois da morte de um voluntário. A informação não foi confirmada pela agência.
fonte G1